还原反应和氧化反应(怎样分析氧化)

凡有元素化合价升降的化学反应都是氧化还原反应,化合价升降是判断氧化还原反应的依据。下面就有关氧化还原反应的分析方法简述于后:
一、一般分析方法
一般可按下列三步进行:
⑴ 标出化学方程式中反应物和生成物里所含元素的化合价。(熟悉后可只标化合价有变化的元素)
⑵ 把有化合价升高或降低的元素分别用线和箭头(双线桥)标出。
⑶ 在线桥上根据化合价的升降,说明被氧化和被还原的情况,指出氧化剂和还原剂。(需根据题意)。
⑷ 注意点:
①有关元素“化合价升高,被氧化”和“化合价降低、被还原”要分别在上、下线桥上一一标明。
②氧化剂、还原剂都是指反应物,所以要在相应的反应物的分子式下面标明,或者另外说明。
③如果标注氧化剂和还原剂时需回答元素名称,必须指明元素的价态。
如上述反应中,“正三价铁元素是氧化剂”或“Fe 是氧化剂”,“正二价碳元素是还原剂”或“C是还原剂”。若无特殊要求,一般只指物质即可。
④在一些比较复杂的氧化一还原反应中,有些元素的化合价在反应前后含有多种变价,则需要用线桥一一标注。

二、氧化还原反应的表示方法
氧化还原反应的表示方法可用单线桥也可用双线桥。
1. 双线桥法
此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子、离子或原子团。
⑴ 标变价:明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
⑵ 连双线:将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
⑶ 标得失:
① 标电子转移或偏离数:明确标出得失电子数,格式为:
“得/失电子数,发生还原/氧化反应,得/失电子数=原子个数×单位原子得失电子数”.
② 标化合价变化:一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等 .
③ 标出元素反应类型:一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确.
④ 检查得失电子守恒:检查得失电子数是否相等,如不相等则重新分析。
例如:Cl2和NaOH反应中电子转移的方向和数目可表示为:
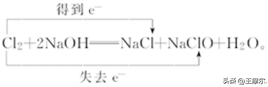
⑷ 注意点:
① 箭头指向反应前后有化合价变化的同种元素的原子,且需注明“得到”或“失去”。
② 线桥的箭头必须由反应物指向生成物。
③ 线桥的起始和终止必须对准同种元素。
④ 箭头的方向不代表电子转移的方向,仅表示电子转移前后的变化。
⑤ 失去电子的总数等于得到电子的总数。
⑥ 习惯上将化合价升高的线桥放在化学方程式的上方,另一线桥则放在下方。
2. 单线桥法
在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。
⑴ 标价态:明确标明发生氧化还原反应的元素的化合价;
⑵ 连单线:连接方程式左边的氧化剂与还原剂,箭头指向氧化剂;
⑶ 标电子转移的总数:标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数。
用单线箭头从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。如MnO2与浓盐酸反应中电子转移的方向和数目可表示为:
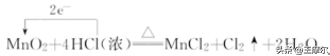
⑷ 注意点:
① 不标“得到”或“失去”,只标明电子转移的总数,否则是错的。
② 箭头从失电子元素的原子指向得电子元素的原子,表示电子转移的方向,指向氧化剂。
③ 线桥只出现在反应物中。
为了规范起见,单线桥法最好不用于自身氧化还原的反应,因为那样标记会使反应中的电子去向不明确,故在自身氧化还原的反应方程式中最好用双线桥法表示电子转移。







